A lo largo de la historia muchas han sido las distintas interpretaciones del átomo y en esta entrada voy a repasar todos estos:
1º- Modelo de Demócrito
Empezamos con el filosofo griego Demócrito, que fue el que desarrolló la teoría atómica del universo(creada por Leucipo, su mentor); en realidad no creó un modelo atómico, sino que definió el concepto de átomo (indivisible), y creó una serie de postulados sobre estos.
Postulados
- Son eternos, indivisibles, homogéneos, incompresibles e invisibles.
- Se diferencian en forma y tamaño, pero no por cualidades internas.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
2º- Modelo de Dalton
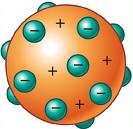
John Dalton, fue un científico inglés, el cual creo el primer modelo de átomo con base científica la humanidad comenzó el camino que la condujo a utilizar la energía atómica.
Postulados
- La materia está formada por unas partículas indivisibles e inalterables llamadas átomos.
- Los de un mismo elemento son iguales en masa y propiedades; mientras que los de distintos elementos los tienen distintos.
- Se pueden combinar y dar lugar a compuestos con relaciones simples.
3º- Modelo de Thomson
El físico británico Joseph John Thomson descubrió el electrón (además de los isotopos y el espectrómetro de masa), al deducir que los rayos catódicos estaban formados por partículas negativas; gracias a este descubrimiento desarrollo su propio modelo atómico (también conocido como pudin de pasas).
Postulados
- El átomo es una esfera de materia cargada positivamente.
- Los electrones se encuentran incrustados en este de manera uniforme.
- El átomo es neutro.
El átomo no es macizo ni compacto sino que es prácticamente hueco y el núcleo es muy pequeño en comparación con el átomo.
4º- Modelo de Rutherford

El químico y físico británico-neozelandés Ernest Rutherford realizó en 1910 un experimento que consistía en bombardear una fina lámina de oro con partículas alfa para comprobar si el modelo de Thomson estaba en lo cierto(según este las partículas deberían atravesar la lamina sin sufrir desviaciones) sin embargo observó que las partículas se desviaban e incluso rebotaban desmintiendo así el modelo de Thomson y creando el suyo propio.

El químico y físico británico-neozelandés Ernest Rutherford realizó en 1910 un experimento que consistía en bombardear una fina lámina de oro con partículas alfa para comprobar si el modelo de Thomson estaba en lo cierto(según este las partículas deberían atravesar la lamina sin sufrir desviaciones) sin embargo observó que las partículas se desviaban e incluso rebotaban desmintiendo así el modelo de Thomson y creando el suyo propio.
Postulados
- El átomo posee un núcleo central pequeño con carga positiva y que contiene casi toda la masa del átomo.
- Los electrones giran alrededor del núcleo en órbitas circulares
- El átomo es eléctricamente neutro
Se contradecía con las leyes del electromagnetismo de Maxwell y no explicaba los espectros atómicos
5º- Modelo de Bohr
El físico danes Niels Bohr ideó, en el año 1913, un nuevo modelo atómico (basándose en el átomo de hidrógeno) que explicaba los espectros de rayas y solventaba los problemas del modelo de Rutherford.
 Postulados
Postulados
5º- Modelo de Bohr
El físico danes Niels Bohr ideó, en el año 1913, un nuevo modelo atómico (basándose en el átomo de hidrógeno) que explicaba los espectros de rayas y solventaba los problemas del modelo de Rutherford.
 Postulados
Postulados- El electrón solo gira en unas órbitas circulares estacionarias en las que no emite energía
- La energía del electrón en cada órbita esta determinada y es mayor cuanto mas alejada se encuentra del núcleo.
- Si el electrón absorbe la energía suficiente salta desde su órbita a otra superior. Cuando deja de recibir esa energía regresa a la órbita inicial emitiendo la energía sobrante en forma de radiación
Sin embargo, los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético tenían distinta energía (subniveles)

No hay comentarios:
Publicar un comentario